Categoría: Farmacovigilancia
Un día cualquiera, en la vida de un médico
17
Ten precaución con la promoción selectiva de estudios
——————————————————————————–
Un día cualquiera, en la vida de un médico
Eulali Mariñelarena Mañeru.
Médica de familia. Coodinadora de la Unidad Docente de Medicina de Familia de Gipuzkoa. Mimebro del Grupo MBE de Osatzen*
* El texto y la presentación ha sido revisado por los miembros del grupo MBE de Osatzen
Presentación
http://prezi.com/som95mc4jm5m/sesgo-de-publicacion/
Hoy, al igual que siempre, recibo a cuatro visitadores médicos antes de lidiar con la intensa agenda, que hoy, como ayer, es modelo “a destajo”. Una vez más escucho las excelencias de productos ya conocidos y ampliamente prescritos pero, a su vez, me voy familiarizando con las novedades farmacoterapéuticas ante su pronta salida al mercado, lo que me asegura adelantarme en información a ese paciente experto en el manejo de Internet y que me vuelve loca.
Esta información viene acompañada de un bonito folleto publicitario donde existe la frase resumen, siguiendo las directrices de las mejores escuelas de marketing, y los grandes resultados que avalan su mensaje. Por supuesto, rodeados siempre por el halo justiciero de la “p” o significación estadística.
Hoy casualmente vienen a presentarme varios fármacos para la próstata, lo cual me viene al pelo porque entre los citados tengo a Juan y tenemos pendiente la valoración de su clínica prostática.
«“Esto parece interesante! ¿Será que va directo a la próstata?”
-“Vaya! Esto me lo tengo que mirar. No recuerdo bien este asunto de la DHT pero ciertamente consigue reducirla de forma muy importante.”
-“Pues mira: esto parece más interesante. Si algo tiene claro Juan es que no se quiere operar.”
Puede, sin embargo, que yo me muestre bastante escéptica a estos mensajes y prefiera recurrir a la búsqueda de los estudios que fundamentan los logros tan vitoreados. Mis pinitos en la MBE van dejando huella…
Quizás exista un ECA, metodológicamente bien hecho, con un gran número de pacientes y con unos resultados concluyentes.
Lo habitual será que encuentre estudios con un pequeño número de pacientes y con periodos de seguimiento cortos y yo, guiada por la prudencia, decida esperar a que la publicación de más estudios sobre el mismo fármaco puedan ser incorporados en un metaanálisis y el resultado final, más robusto, me ofrezca mayor seguridad en la decisión que adopte.
Tras una tarde de “zapineo” en la tele −que nos muestra un mundo habitado por asesinos, violadores, traficantes, señores de la guerra, mentirosos, incitadores del miedo, politiquillos de poca monta, usurpadores de intimidades−, me pregunto si las publicaciones científicas se regirán por el mismo patrón que la difusión de noticias en los medios de comunicación de masas, ocultando otras realidades que no cumplen el requisito de ser noticiables.
Lo cierto es que, bien porque el propio investigador decide no publicar un estudio que no consigue avalar su hipótesis de partida, bien porque al editor no le gustan los estudios sin diferencias estadísticamente significativas, bien porque la ocultación de datos responde a una estrategia concreta, lo cierto es que tal y como muestra una RS de la colaboración Cochrane los ensayos clínicos con resultados positivos tienen una mayor probabilidad de ser publicados que los ensayos clínicos con resultados no significativos o nulos (OR: 3,90; IC 95%: 2,68 a 5,68).(1)
Otra variante más de este sesgo consistente en la publicación incompleta de resultados, ya lo anunciaba la revista JAMA en 2004(2): el 50% de variables eficacia y el 65% de seguridad son publicadas de forma incompleta; significativamente más evidente en las variables sin diferencias significativas. Así lo confirman los datos preliminares del proyecto ORBIT (Outcome Reporting Bias in Trials), recientemente publicados. Tal y como podemos leer en el Rincón de Sísifo, la prevalencia de la publicación incompleta de los estudios es alta y generalmente los investigadores no son conscientes de las implicaciones de esta práctica tiene como objetivo cuantificar este sesgo en la presentación de resultados sobre la variable principal. Algunos datos preliminares ya publicados reafirman la frecuencia de esta práctica con poca consciencia de los investigadores sobre las consecuencias de ésta.
Si a todo ello le sumamos el fenómeno de la duplicación, por el que los mismos resultados positivos son presentados como integrantes de estudios diferentes(3), la interpretación que hacemos, puede estar claramente distorsionada
Me pregunto… ¿tendrá esto consecuencias?: pues parece que sí, veamos unos ejemplos:
- A lo largo de la década de los 80, el uso profuso de antiarrítmicos tras un IAM se estima que provocó miles de muertes prematuras, que quizás se hubiesen evitado de haberse dado a conocer los resultados del estudio realizado con el antiarrítmico lorcainida, pero que por razones comerciales no se llegó a comercializar ni se llegaron a publicar sus resultados(4).
- El escándalo en torno a la ocultación de datos sobre el aumento de incidencia de infartos del VIOXX, finalmente retirado del mercado, es todavía reciente(5).
- La eficacia de la reboxetina, antidepresivo con gran cuota de mercado en Alemania, basada en resultados sobre sólo 1.600 pacientes de los 4.600 estudiados ha provocado la amenaza de retirada de financiación de la agencia alemana del medicamento (IQWIG). Tras una nueva reevaluación de los datos, publicados y no publicados, patrocinada por la propia agencia se ha descubierto que reboxetina es inferior a otros ISRS con los que se compara y sin diferencias significativas frente a placebo(6).
- La valoración conjunta de datos publicados y no publicados sobre el tratamiento de la depresión en la infancia y la adolescencia sugiere un perfil beneficio/riesgo desfavorable para los ISRS, excepto para la fluoxetina, contrariamente a lo que se sabía en base a los datos publicados(7).
- La reciente suspensión de la comercialización de la rosiglitazona, por su relación con el aumento de eventos cardiovasculares(8), es otro claro ejemplo de ocultación de datos por parte de la industria farmacéutica a la comunidad científica.
Ante esta situación de zozobra: ¿Qué se puede hacer?… Pues algunas medidas les corresponde tomarlas a otros:
- Implantar un registro de todos los ensayos clínicos que se vayan a realizar y la información que deben contener(9).
- Regular el libre acceso a los ensayos clínicos.
- Acordar por parte del consejo editorial de las revistas la no publicación de estudios que no cuenten con el registro previo.
- Sensibilizar a los investigadores en la relevancia de los datos aun cuando no encuentren diferencias significativas.
-“Pero y yo ¿qué puedo hacer?”
Ante la lectura de una RS comprobar si:
Se describe búsqueda de literatura gris, contacto con autores.
- ¿Han utilizado restricción de idioma?: Los autores cuyo idioma no es el inglés suelen publicar resultados positivos en revistas en inglés, ya que éstas poseen mayor impacto internacional. Los resultados negativos tienden a publicarse en revistas en otros idiomas diferentes al inglés.
- Se conoce la fuente de financiación: Los ECAs financiados por la industria presentan mayor probabilidad de presentar resultados favorables a la intervención estudiada y menor probabilidad de haber publicado sus resultados transcurridos dos años de su finalización(10).
- Describen algún método para detectar un posible sesgo de publicación.
- Recordar que ante la información del folleto publicitario:
- Huir de la seducción de la “p” y de la frase resumen.
- Valorar el resultado que nos muestran y preguntarnos con mirada del paciente si es el importante.
- Escudriñar la representación gráfica no vaya a ser que encontremos los gráficos manipulados.
- Mirar la bibliografía que sustenta las afirmaciones: ¿son comunicaciones a congresos o posters ?
Puedo finalmente consultar cualquiera de los estupendos boletines o blogs farmacoterapéuticos que están disponibles en la red o bien Iniciativas como la crítica a la publicidad de nuevos medicamentos del Comité Vasco de evaluación de nuevos medicamentos, que pueden ayudarnos a desenmascarar las medias o la ausencia de verdades que en un alto porcentaje de los casos se publicitan.
Bibliografía
1. Hopewell S, Loudon K, Clarke MJ, Oxman AD, Dickersin K. Publication bias in clinical trials due to statistical significance or direction of trial results. Cochrane Database Syst Rev. 2009(1):MR000006.
2. Chan AW, Hróbjartsson A, Haahr MT, Gøtzsche PC, Altman DG. Empirical evidence for selective reporting of outcomes in randomized trials: comparison of protocols to published articles. JAMA. 2004;291(20):2457-65.
3. interpretando la literatura médica:¿Qué necesito saber?. Parte I. INFAC [Internet]. 2006; 14(7).
4. Cowley AJ, Skene A, Stainer K, Hampton JR. The effect of lorcainide on arrhythmias and survival in patients with acute myocardial infarction: an example of publication bias. International Journal of Cardiology. 1993;40(2):161-6.
5. Topol EJ. Failing the Public Health — Rofecoxib, Merck, and the FDA. New England Journal of Medicine. 2004;351(17):1707-9.
6. Eyding D, Lelgemann M, Grouven U, Härter M, Kromp M, Kaiser T, et al. Reboxetine for acute treatment of major depression: systematic review and meta-analysis of published and unpublished placebo and selective serotonin reuptake inhibitor controlled trials. BMJ. 2010;341.
7. Whittington CJ, Kendall T, Fonagy P, Cottrell D, Cotgrove A, Boddington E. Selective serotonin reuptake inhibitors in childhood depression: systematic review of published versus unpublished data. Lancet. 2004;363(9418):1341-5.
8. Juurlink DN. Rosiglitazone and the Case for Safety Over Certainty. JAMA: The Journal of the American Medical Association. 2010;304(4):469-71.
9. De Angelis C, Drazen JM, Frizelle FA, Haug C, Hoey J, Horton R, et al. Clinical trial registration: a statement from the International Committee of Medical Journal Editors. N Engl J Med. 2004;351(12):1250-1.
10. Lexchin J, Bero LA, Djulbegovic B, Clark O. Pharmaceutical industry sponsorship and research outcome and quality: systematic review. BMJ. England2003. p. 1167-70.
A no ser que en el documento figure lo contrario este trabajo se encuentra dentro de la Iniciativa para una Prescripción Prudente por Varios Autores sujeta a una licencia Creative Commons un Reconocimiento-NoComercial-CompartirIgual 3.0 Unported (CC BY-NC-SA 3.0)
17
Ten precaución con la promoción selectiva de estudios
——————————————————————————–
Un día cualquiera, en la vida de un médico
Eulali Mariñelarena Mañeru.
Médica de familia. Coodinadora de la Unidad Docente de Medicina de Familia de Gipuzkoa. Mimebro del Grupo MBE de Osatzen*
* El texto y la presentación ha sido revisado por los miembros del grupo MBE de Osatzen
Presentación
http://prezi.com/som95mc4jm5m/sesgo-de-publicacion/
Texto:
Hoy, al igual que siempre, recibo a cuatro visitadores médicos antes de lidiar con la intensa agenda, que hoy, como ayer, es modelo “a destajo”. Una vez más escucho las excelencias de productos ya conocidos y ampliamente prescritos pero, a su vez, me voy familiarizando con las novedades farmacoterapéuticas ante su pronta salida al mercado, lo que me asegura adelantarme en información a ese paciente experto en el manejo de Internet y que me vuelve loca.
Esta información viene acompañada de un bonito folleto publicitario donde existe la frase resumen, siguiendo las directrices de las mejores escuelas de marketing, y los grandes resultados que avalan su mensaje. Por supuesto, rodeados siempre por el halo justiciero de la “p” o significación estadística.
Hoy casualmente vienen a presentarme varios fármacos para la próstata, lo cual me viene al pelo porque entre los citados tengo a Juan y tenemos pendiente la valoración de su clínica prostática.
-“Esto parece interesante! ¿Será que va directo a la próstata?”
-“Vaya! Esto me lo tengo que mirar. No recuerdo bien este asunto de la DHT pero ciertamente consigue reducirla de forma muy importante.”
-“Pues mira: esto parece más interesante. Si algo tiene claro Juan es que no se quiere operar.”
Puede, sin embargo, que yo me muestre bastante escéptica a estos mensajes y prefiera recurrir a la búsqueda de los estudios que fundamentan los logros tan vitoreados. Mis pinitos en la MBE van dejando huella…
Quizás exista un ECA, metodológicamente bien hecho, con un gran número de pacientes y con unos resultados concluyentes.
Lo habitual será que encuentre estudios con un pequeño número de pacientes y con periodos de seguimiento cortos y yo, guiada por la prudencia, decida esperar a que la publicación de más estudios sobre el mismo fármaco puedan ser incorporados en un metaanálisis y el resultado final, más robusto, me ofrezca mayor seguridad en la decisión que adopte.
Tras una tarde de “zapineo” en la tele −que nos muestra un mundo habitado por asesinos, violadores, traficantes, señores de la guerra, mentirosos, incitadores del miedo, politiquillos de poca monta, usurpadores de intimidades−, me pregunto si las publicaciones científicas se regirán por el mismo patrón que la difusión de noticias en los medios de comunicación de masas, ocultando otras realidades que no cumplen el requisito de ser noticiables.
Lo cierto es que, bien porque el propio investigador decide no publicar un estudio que no consigue avalar su hipótesis de partida, bien porque al editor no le gustan los estudios sin diferencias estadísticamente significativas, bien porque la ocultación de datos responde a una estrategia concreta, lo cierto es que tal y como muestra una RS de la colaboración Cochrane los ensayos clínicos con resultados positivos tienen una mayor probabilidad de ser publicados que los ensayos clínicos con resultados no significativos o nulos (OR: 3,90; IC 95%: 2,68 a 5,68).(1)
Otra variante más de este sesgo consistente en la publicación incompleta de resultados, ya lo anunciaba la revista JAMA en 2004(2): el 50% de variables eficacia y el 65% de seguridad son publicadas de forma incompleta; significativamente más evidente en las variables sin diferencias significativas. Así lo confirman los datos preliminares del proyecto ORBIT (Outcome Reporting Bias in Trials), recientemente publicados. Tal y como podemos leer en el Rincón de Sísifo, la prevalencia de la publicación incompleta de los estudios es alta y generalmente los investigadores no son conscientes de las implicaciones de esta práctica tiene como objetivo cuantificar este sesgo en la presentación de resultados sobre la variable principal. Algunos datos preliminares ya publicados reafirman la frecuencia de esta práctica con poca consciencia de los investigadores sobre las consecuencias de ésta.
Si a todo ello le sumamos el fenómeno de la duplicación, por el que los mismos resultados positivos son presentados como integrantes de estudios diferentes(3), la interpretación que hacemos, puede estar claramente distorsionada
Me pregunto… ¿tendrá esto consecuencias?: pues parece que sí, veamos unos ejemplos:
- A lo largo de la década de los 80, el uso profuso de antiarrítmicos tras un IAM se estima que provocó miles de muertes prematuras, que quizás se hubiesen evitado de haberse dado a conocer los resultados del estudio realizado con el antiarrítmico lorcainida, pero que por razones comerciales no se llegó a comercializar ni se llegaron a publicar sus resultados(4).
- El escándalo en torno a la ocultación de datos sobre el aumento de incidencia de infartos del VIOXX, finalmente retirado del mercado, es todavía reciente(5).
- La eficacia de la reboxetina, antidepresivo con gran cuota de mercado en Alemania, basada en resultados sobre sólo 1.600 pacientes de los 4.600 estudiados ha provocado la amenaza de retirada de financiación de la agencia alemana del medicamento (IQWIG). Tras una nueva reevaluación de los datos, publicados y no publicados, patrocinada por la propia agencia se ha descubierto que reboxetina es inferior a otros ISRS con los que se compara y sin diferencias significativas frente a placebo(6).
- La valoración conjunta de datos publicados y no publicados sobre el tratamiento de la depresión en la infancia y la adolescencia sugiere un perfil beneficio/riesgo desfavorable para los ISRS, excepto para la fluoxetina, contrariamente a lo que se sabía en base a los datos publicados(7).
- La reciente suspensión de la comercialización de la rosiglitazona, por su relación con el aumento de eventos cardiovasculares(8), es otro claro ejemplo de ocultación de datos por parte de la industria farmacéutica a la comunidad científica.
Ante esta situación de zozobra: ¿Qué se puede hacer?… Pues algunas medidas les corresponde tomarlas a otros:
- Implantar un registro de todos los ensayos clínicos que se vayan a realizar y la información que deben contener(9).
- Regular el libre acceso a los ensayos clínicos.
- Acordar por parte del consejo editorial de las revistas la no publicación de estudios que no cuenten con el registro previo.
- Sensibilizar a los investigadores en la relevancia de los datos aun cuando no encuentren diferencias significativas.
-“Pero y yo ¿qué puedo hacer?”
Ante la lectura de una RS comprobar si:
- Se describe búsqueda de literatura gris, contacto con autores.
- ¿Han utilizado restricción de idioma?: Los autores cuyo idioma no es el inglés suelen publicar resultados positivos en revistas en inglés, ya que éstas poseen mayor impacto internacional. Los resultados negativos tienden a publicarse en revistas en otros idiomas diferentes al inglés.
- Se conoce la fuente de financiación: Los ECAs financiados por la industria presentan mayor probabilidad de presentar resultados favorables a la intervención estudiada y menor probabilidad de haber publicado sus resultados transcurridos dos años de su finalización(10).
- Describen algún método para detectar un posible sesgo de publicación.
- Recordar que ante la información del folleto publicitario:
- Huir de la seducción de la “p” y de la frase resumen.
- Valorar el resultado que nos muestran y preguntarnos con mirada del paciente si es el importante.
- Escudriñar la representación gráfica no vaya a ser que encontremos los gráficos manipulados.
- Mirar la bibliografía que sustenta las afirmaciones: ¿son comunicaciones a congresos o posters ?
Puedo finalmente consultar cualquiera de los estupendos boletines o blogs farmacoterapéuticos que están disponibles en la red o bien Iniciativas como la crítica a la publicidad de nuevos medicamentos del Comité Vasco de evaluación de nuevos medicamentos, que pueden ayudarnos a desenmascarar las medias o la ausencia de verdades que en un alto porcentaje de los casos se publicitan.
Bibliografía
1. Hopewell S, Loudon K, Clarke MJ, Oxman AD, Dickersin K. Publication bias in clinical trials due to statistical significance or direction of trial results. Cochrane Database Syst Rev. 2009(1):MR000006.
2. Chan AW, Hróbjartsson A, Haahr MT, Gøtzsche PC, Altman DG. Empirical evidence for selective reporting of outcomes in randomized trials: comparison of protocols to published articles. JAMA. 2004;291(20):2457-65.
3. interpretando la literatura médica:¿Qué necesito saber?. Parte I. INFAC [Internet]. 2006; 14(7).
4. Cowley AJ, Skene A, Stainer K, Hampton JR. The effect of lorcainide on arrhythmias and survival in patients with acute myocardial infarction: an example of publication bias. International Journal of Cardiology. 1993;40(2):161-6.
5. Topol EJ. Failing the Public Health — Rofecoxib, Merck, and the FDA. New England Journal of Medicine. 2004;351(17):1707-9.
6. Eyding D, Lelgemann M, Grouven U, Härter M, Kromp M, Kaiser T, et al. Reboxetine for acute treatment of major depression: systematic review and meta-analysis of published and unpublished placebo and selective serotonin reuptake inhibitor controlled trials. BMJ. 2010;341.
7. Whittington CJ, Kendall T, Fonagy P, Cottrell D, Cotgrove A, Boddington E. Selective serotonin reuptake inhibitors in childhood depression: systematic review of published versus unpublished data. Lancet. 2004;363(9418):1341-5.
8. Juurlink DN. Rosiglitazone and the Case for Safety Over Certainty. JAMA: The Journal of the American Medical Association. 2010;304(4):469-71.
9. De Angelis C, Drazen JM, Frizelle FA, Haug C, Hoey J, Horton R, et al. Clinical trial registration: a statement from the International Committee of Medical Journal Editors. N Engl J Med. 2004;351(12):1250-1.
10. Lexchin J, Bero LA, Djulbegovic B, Clark O. Pharmaceutical industry sponsorship and research outcome and quality: systematic review. BMJ. England2003. p. 1167-70.
A no ser que en el documento figure lo contrario este trabajo se encuentra dentro de la Iniciativa para una Prescripción Prudente por Varios Autores sujeta a una licencia Creative Commons un Reconocimiento-NoComercial-CompartirIgual 3.0 Unported (CC BY-NC-SA 3.0)
la maldición de la osteoporosis
Resumen:
Susan Ott es una médico Internista especializada en enfermedades metabólicas que mantiene un magnifico curso on line sobre osteoporosis de gran utilidad para los que quieren desbrozar y aclararse en el proceloso mundo de la osteoporosis y su tratamiento. Susan es la autora de una revisión publicada en la revista Cleveland Clinic Journal of Medicine cuyo objetivo es determinar la duración optima del tratamiento para la osteoporosis y que ha tenido bastante repercusión en nuestro país, tanto en prensa general, como blogs especializados.
Importante este tema de la duración de los tratamientos que en nuestro país se suele zanjar con el contundente «de por vida».
En esta revisión se recomienda suspender el tratamiento con bifosfonatos a los cinco años. La autora no se recata en decir que las razones para esa afirmación son una mezcla de opiniones y débiles evidencias. Las recomendaciones que da para el manejo de la suspensión del tratamiento y control posterior de los pacientes están basadas en su opinión y experiencia ante la escasez de pruebas fehacientes que sirvan para guiar la toma de decisiones. Felizmente también nos recuerda que muchas de las decisiones, no solo ya de continuar el tratamiento con estos medicamentos, sino incluso de iniciarlo en determinados casos (osteopenia, riesgo bajo de fracturas, densitometría como único criterio, medicina basada en el marketing) carecen, asimismo, de pruebas suficientes.
En cualquier caso se debe recordar el aforismo que da nombre a ese blog “Primun non nocere”
Con la misma lucidez que nos lleva reconocer su poca evidencia, NO habría que tener recato en suspender a los cinco años un tratamiento que probablemente no se debía haber empezado. En los casos en que esa indicación estuviera más clara, una explicación fisiológica, la ausencia de beneficio (que no es lo mismo que beneficio de la ausencia) y la probabilidad (pequeña) de efectos adversos como la fracturas atípicas serian suficientes, a la espera de mejor evidencia, para establecer la duración óptima del tratamiento con bisfosfonatos para la osteoporosis en cinco años.
Médicaments : priorité à l’intérêt des patients et à la santé publique
 Prescrire, uno de los Boletines decanos de la ISDB ( Sociedad Internacional de Boletines de Medicamentos independientes) que hace unos pocos días fue noticia por la demanda del laboratorio Astellas Pharma, ha elaborado un documento de propuestas como repuesta a su participación en la conferencia nacional de Francia sobre política de medicamentos iniciada a raíz del escándalo en este pais del Mediator (benfluorex).
Prescrire, uno de los Boletines decanos de la ISDB ( Sociedad Internacional de Boletines de Medicamentos independientes) que hace unos pocos días fue noticia por la demanda del laboratorio Astellas Pharma, ha elaborado un documento de propuestas como repuesta a su participación en la conferencia nacional de Francia sobre política de medicamentos iniciada a raíz del escándalo en este pais del Mediator (benfluorex).
Las propuestas son:
- Criterios más estrictos para la autorización de comercialización
- Financiación pública para la educación continua y la información sobre medicamentos
- Fortalecer la competencia por parte de los organismos reguladores y otras autoridades en relación con los medicamentos
- Mejorar y generalizar la transparencia entre las agencias reguladoras y otros organismos oficiales relacionados medicamentos
- Farmacovigilancia proactiva y robusta
- Formación inicial de los profesionales de la salud libre de la influencia de la industria
- Educación continua o profesionales de la salud verdaderamente enfocada a mejorar las prácticas
- La información de calidad para el público en general, para fomentar la toma conjunta de decisiones entre pacientes y profesionales de la salud
- El interés de los pacientes en primer lugar de la práctica profesional
Traducción resumida de Traducción de Martín Cañás Sigue leyendo
a vueltas con los protectores
En mayo de este año, la Food and Drug Administration (FDA) avisaba de que los inhibidores de la bomba de protones (IBP) podrían estar asociados con un aumento del riesgo de fracturas de cadera,muñeca y columna vertebral. Esta advertencia se basaba en la revisión de varios estudios epidemiológicos que encontraron, además, que el mayor riesgo de estas fracturas se daba en pacientes mayores, que consumían altas dosis de IBP o los utilizaban durante períodos superiores a 1 año.
De forma general se puede considerar que los IBPs son fármacos seguros incluso a largo plazo, con una baja tasa de efectos secundarios y pocos de ellos graves.
 ¿Cuál es el problema entonces?
¿Cuál es el problema entonces?
• El problema es que el escenario comentado anteriormente, persona mayor, IBP crónicos y dosis generosas, es muy frecuente en nuestras consultas.
• El problema es que la protección gástrica es el nuevo paradigma que inequívocamente lleva a la sobreutilización injustificada de estos medicamentos. Este uso excesivo y extendido hace que, aunque el riesgo de efectos adversos como la osteoporosis y las fracturas consiguientes sea bajo, la magnitud del problema es importante porque afecta en potencia a un gran número de personas.
• El problema es que los IBP tienen una relación beneficio/riesgo muy favorable pero se olvida con facilidad que el denominador no es cero, es decir que su consumo no está exento de riesgo.
• El problema es que, como se señala en diveras publicaciones, el consumo de IBP se ha disparado de manera injustificada en los últimos años por diversas causas, que van desde las indicaciones no claras a los tratamientos demasiado largos, pasando por la automedicación y el precio ridículo.
Estas causas se exponen, junto a las indicaciones y efectos adversos, en ese boletín INFAC monográfico de recomendable lectura, como todos los realizados por el Centro Vasco de Información de Medicamentos CEVIME-MIE
Tampoco podrá ser ajena una desafortunada política de promoción de genéricos y dos peculiares y modernas formas de utilización de los IBP: el aumento de dosis y su utilización en síntomas y enfermedades extraesofágicas como el asma, tos crónica, o laringitis, se presupone en todas ellas un origen relacionado con el reflujo del contenido gástrico. Como se pone de manifiesto en una revisión narrativa reciente, en estos casos el ensayo empírico con IBP ha sido y sigue siendo el enfoque inicial, si bien recientes estudios aleatorizados, controlados con placebo, en estas afecciones han sido poco concluyentes a la hora de mostrar si existe beneficio de la terapia de supresión ácida.
con receta
Tranquilos que es en México. En España esas cosas no pasan:
Según un estudio realizado por especialistas catalanes, las farmacias en nuestro país siguen vendiendo antibióticos, y más cosas (N del T) sin receta. La investigación, que comenzó en 2008, muestra que de las 197 farmacias visitadas, se obtuvieron antibióticos sin receta en 89 de ellas, principalmente las de menor tamaño, mientras que las grandes seguían más estrechamente la legislación.
tomado de ‘Por favor, ¡la receta!’ publicado en El Mundo
los «riesgos» de la sibutramina: formas de expresarlo
Los resultados mostraron un incremento del riesgo cardiovascular de sibutramina (561/4906, 11,4%) en comparación con placebo (490/4898, 10%) en la variable principal (infarto de miocardio, ictus, o parada cardiaca no mortal y muerte de origen cardiovascular) con un incremento de riesgo del 16% (Hazard Ratio 1,161; IC 95% 1,029-1,311), a expensas de un aumento de la incidencia de infarto de miocardio e ictus no mortales.  En el grupo control 100 personas de 1000 tendrán infarto de miocardio, ictus, o parada cardíaca no mortal y muerte de origen cardiovascular , comparado con 114 (95% IC 102 a 128) de 1000 en el grupo tratado con Sibutramina.
En el grupo control 100 personas de 1000 tendrán infarto de miocardio, ictus, o parada cardíaca no mortal y muerte de origen cardiovascular , comparado con 114 (95% IC 102 a 128) de 1000 en el grupo tratado con Sibutramina.


Se retira del mercado la sibutramina
Nota de la Agencia Española del Medicamento
 Suspensión cautelar de comercialización de SIBUTRAMINA (REDUCTIL®):
Suspensión cautelar de comercialización de SIBUTRAMINA (REDUCTIL®):
Como continuación de la nota informativa 2009/13, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) comunica a los profesionales sanitarios que se ha tomado la decisión de suspender la comercialización de sibutramina, disponible en España con el nombre comercial Reductil®.
Tras la revisión de los resultados preliminares del estudio SCOUT (Sibutramine Cardiovascular OUTcome trial) y los datos disponibles sobre la eficacia de sibutramina, el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) ha concluido que, con la información actualmente disponible, el balance beneficio-riesgo de sibutramina es desfavorable. Como se informó previamente en la nota informativa 2009/13, el estudio SCOUT se diseñó para conocer el impacto de la pérdida de peso obtenida con el tratamiento con sibutramina sobre el riesgo cardiovascular en pacientes con alto riesgo cardiovascular. Este estudio incluyó aproximadamente 10.000 pacientes con una duración de tratamiento de hasta 6 años.
El beneficio a largo plazo observado en estudio SCOUT para sibutramina en términos de pérdida media de peso fue muy modesto en relación a placebo (3,6 kg vs 1,6 kg). Por otra parte, los resultados mostraron un incremento del riesgo cardiovascular de sibutramina (561/4906, 11,4%) en comparación con placebo (490/4898, 10%) en la variable principal (infarto de miocardio, ictus, o parada cardiaca no mortal y muerte de origen cardiovascular) con un incremento de riesgo del 16% (Hazard Ratio 1,161; IC 95% 1,029-1,311), a expensas de un aumento de la incidencia de infarto de miocardio e ictus no mortales. No se observaron diferencias significativas entre sibutramina y placebo en cuanto a mortalidad global.
Aunque la mayoría de los pacientes incluidos en este estudio no serían candidatos al tratamiento con sibutramina en las condiciones de uso autorizadas (fundamentalmente por presentar patología cardiovascular que supone una contraindicación del tratamiento), el CHMP ha considerado que los resultados del estudio SCOUT son
relevantes para el uso del medicamento en la práctica clínica habitual teniendo en cuenta que los pacientes con sobrepeso suelen tener mayor riesgo cardiovascular y que este puede ser difícil de identificar.
En base a estos resultados, se ha concluido que el beneficio esperado para sibutramina no supera los riesgos potenciales, recomendándose por tanto la suspensión de la autorización de comercialización de los medicamentos que contienen sibutramina. Dicha suspensión de comercialización se formalizará con la correspondiente decisión de la Comisión Europea.
Mientras tanto, la AEMPS considera necesario indicar a los profesionales sanitarios lo siguiente:
- Médicos prescriptores: no deberá prescribirse Reductil® a partir del 1 de febrero de 2010, por lo que no deben iniciarse nuevos tratamientos ni continuarse los actualmente en curso.
- Farmacéuticos: no debe dispensarse ninguna prescripción de Reductil® ni elaborar ninguna fórmula magistral con el principio activo sibutramina a partir del 1 de febrero de 2010. En el caso de que un paciente solicite una dispensación de Reductil®, se le debe informar que se ha suspendido la comercialización de dicho medicamento y que debe consultar con su médico para valorar las alternativas disponibles para su caso particular. Las devoluciones al laboratorio comercializador se harán por los cauces habituales.
Se puede consultar la nota pública y documento de preguntas y respuestas de la EMA en su página web: nota de prensa e información para pacientes así como la información para pacientes en español de la agemed
Sibutramina e incremento riesgo cardiovascular
COMUNICACIÓN SOBRE RIESGOS DE MEDICAMENTOS PARA PROFESIONALES SANITARIOS
Ref: 2009/13 18 de diciembre de 2009
NOTA INFORMATIVA : SIBUTRAMINA E INCREMENTO DE RIESGO CARDIOVASCULAR
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) informa a los profesionales sanitarios sobre la revisión del perfil de seguridad de sibutramina, que está llevando a cabo el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos.
Sibutramina está comercializada en nuestro país con el nombre Reductil®, en cápsulas de 10 y 15 mg. Su uso está indicado como terapia complementaria dentro de un programa integral de control de peso en pacientes con obesidad, o pacientes con sobrepeso que presenten otros factores de riesgo como diabetes tipo 2 o dislipidemia.
En dicha revisión se están analizando los datos obtenidos en el ensayo clínico SCOUT (Sibutramine Cardiovascular OUTcome trial). El objetivo principal de este estudio fue determinar el impacto del tratamiento a largo plazo con sibutramina sobre el riesgo cardiovascular. Dicho estudio ha incluido aproximadamente 10.000 pacientes obsesos o con sobrepeso, con enfermedad cardiovascular y/o diagnóstico de diabetes tipo 2 con al menos un factor de riesgo adicional para enfermedad cardiovascular. Los pacientes fueron asignados aleatoriamente a recibir tratamiento con sibutramina 10 mg/día o placebo durante un período de 5 años.
De acuerdo con las condiciones de uso autorizadas actualmente para el medicamento, el tratamiento con sibutramina estaría contraindicado en la mayoría de los pacientes incluidos en el ensayo clínico. Entre los resultados principales obtenidos en el estudio, se observa un incremento de riesgo de acontecimientos cardiovasculares graves (como infarto de miocardio o ictus) en los pacientes tratados con sibutramina.
Actualmente, se están valorando las implicaciones que estos datos pudieran tener sobre el uso de sibutramina en la práctica clínica habitual, y se espera que dicha evaluación concluya a finales de enero. Mientras tanto, la AEMPS considera necesario emitir las siguientes recomendaciones sobre el uso de sibutramina:
El tratamiento con sibutramina se debe ajustar estrictamente a las condiciones de uso autorizadas
Se recuerda que:
- El uso de sibutramina está contraindicado, entre otros, en pacientes con antecedentes de cardiopatía isquémica, insuficiencia cardiaca congestiva, taquicardia, enfermedad oclusiva arterial periférica, arritmia o enfermedad cerebrovascular (ictus o accidente isquémico transitorio).
- En aquellos pacientes en los que no se obtenga respuesta adecuada en 3 meses (perdida de al menos un 5% de su peso corporal), se deberá suspender el tratamiento.
- El tiempo de tratamiento no deberá ser superior a un año.
- Se puede consultar la nota pública de la Agencia Europea de Medicamentos en su página web
Asimismo, pueden consultar la ficha técnica y el prospecto de este medicamento en la página web de la AEMPS (www.aemps.es)
¿para cuando una aplicación práctica de las nuevas tecnologías?
Que fácil sería que las historias clínicas electrónicas tuvieran una alerta que saltara, por ejemplo, cuando a un hombre con el diagnóstico de cataratas se le fuera a prescribir un bloqueante alfa como la tamsulosina. ¡Hombre! uno se puede acordar de la nota de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) que hace dos años (2007) anunciaba:
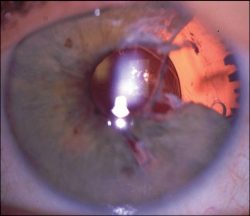 La (AEMPS) considera necesario informar a los profesionales sanitarios sobre nuevos datos de seguridad relativos al uso de bloqueantes alfa-1 adrenérgicos (tamsulosina, alfuzosina, doxazosina, prazosina y terazosina) en relación a su uso en pacientes sometidos a cirugía de cataratas mediante facoemulsificación.
La (AEMPS) considera necesario informar a los profesionales sanitarios sobre nuevos datos de seguridad relativos al uso de bloqueantes alfa-1 adrenérgicos (tamsulosina, alfuzosina, doxazosina, prazosina y terazosina) en relación a su uso en pacientes sometidos a cirugía de cataratas mediante facoemulsificación.
Durante la cirugía de cataratas, en algunos pacientes que están en tratamiento o han sido tratados previamente con bloqueantes alfa-1 adrenérgicos, se ha observado un síndrome quirúrgico denominado “Síndrome del Iris Flácido Intraoperatorio” *. Las consecuencias principales de la presentación de IFIS son complicaciones de la cirugía y posible compromiso de la mejora visual obtenida con la misma
Pero como uno no tiene memoria de elefante una ayudita, viene como anillo al dedo. Esto es un uso adecuado de las nuevas tecnologías. La cita vía Internet esta muy bien, pero no deja de ser una comodidad, lo que realmente influye en la seguridad y calidad de la asistencia es por ejemplo, un sistema adecuados de alertas. Ya se que con esto no se sale en los periódicos, pero se salvan vidas, ¡de verdad!
Todo ello a propósito del artículo y editorial que publica JAMA esta semana y de Miguel que tuvo la suerte de que su médico de cabecera estuvo presto a retirarle el dichoso Omnic del urólogo, justo antes de que le operaran de cataratas.
A veces ser el hacedor de recetas de los especialistos tiene ventajas….¡para el paciente!
* en ingles Intraoperative Floppy Iris Síndrome: IFIS
Nota actualización Octubre 2016: se corrige enlace la nota de la AEMPS y se recomienda la lectura de los comentarios